Sphérification
De quoi s'agit-il ?
En cuisine moléculaire, on utilise cette réaction chimique pour réaliser des boules gélifiées appelées aussi caviars. A partir d’un liquide (sirops, cocktails, jus de fruits…) et d’éléments chimiques (alginate de sodium et chlorure de calcium), on peut fabriquer des sphères solides parfumées. Il s’agit d’une nouvelle technique découverte en 2003 par Ferran Adria chef du grand restaurant Espagnol El Bulli.
Il existe deux types de sphérification : la sphérification inverse et la sphérification basique.
- La sphérification basique : On verse goutte à goutte une solution d’un liquide parfumé contenant de l’alginate de sodium dissout, dans un bain de chlorure de calcium mélangée avec de l’eau pour obtenir les sphères.
- La sphérification inverse : c’est une variante de la sphérification basique consistant à plonger un liquide naturellement riche en calcium dans un bain d'alginate.
La sphérification basique ou inverse est un procédé de gélification qui n'est pas réversible.
Les ingrédients :
- L’alginate de sodium :
- Le chlorure de calcium :
L'alginate de sodium est un produit naturel extrait de la paroi des algues brunes marines. Elles représentent les algues les plus abondantes des mers tempérées et froides. Dans l’industrie de l’alimentation connue sous le nom de E401, les alginates sont employés comme additif alimentaire afin de gélifier ou épaissir. Dernièrement ils servent aussi à créer des perles « caviar » de différents goûts. Il est vendu sous forme de poudre blanche.
Chimiquement, il s’agit d’une longue chaîne de molécule. Sa formule est C6H7NaO6. Par définition, c’est un polymère : désigne un composé obtenu par polymérisation, réaction chimique consistant à lier des monomères pour obtenir une macromolécule. Les monomères sont des sucres dans le cas de l’alginate. En effet l'alginate de sodium fait partie de la famille des glucides, c’est un polysaccharide composé de deux monomères combinés : acide D-mannuroniques et acide L-glucuroniques. C’est une longue chaîne comportant beaucoup de charges négatives par la présence de groupements carboxyles (COO-) et de l'ion Na+ ce qui la rend électriquement neutre. L’alginate est soluble sous quelques conditions (par exemple, pH>4).
Le chlorure de calcium, est un sel de calcium. Sa formule chimique est CaCl2. Il est très soluble dans l'eau. (CaCl2 à Ca2+ (aq) + + 2Cl- (aq) )
Comment s’explique la réaction chimique ?
La réalisation des perles d’alginate nécessite la présence de calcium.
L’acide alginique contenu dans une solution d’alginate de sodium en solution aqueuse perd une liaison hydrogène d’où la provenance des ions COO- (réaction acido-basique où l’eau est à la fois acide et base.)
C6H8O6 (s) + H2O (l) -----> C6H7O6- (aq) + H3O+
Le calcium (Ca) contenu dans le chlorure de calcium en solution aqueuse devient ion calcium (Ca2+). Lorsque l’alginate de sodium rencontre du calcium, les ions calcium Ca2+ déplacent les ions sodium. Les ions calcium étant divalents (doublement chargés positivement), ils réagissent avec deux groupements de COO- et il y a donc une polymérisation puisque les ions calcium permettent de « lier » deux chaînes d’alginate entre elles. On appelle cela une réaction de réticulation : ce sont des molécules qui s’attachent entre elles par des liaisons chimiques formant des « ponts ». Cela permet la formation d'un gel, le liquide contenant l'alginate devient épais, il durcit et c'est ainsi que se forme une peau souple à la surface de notre sphère. La réaction est instantanée.
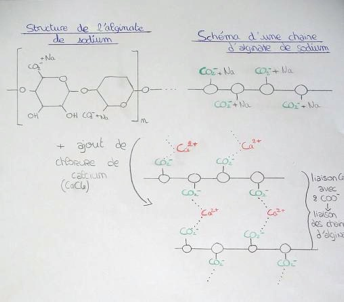
Schéma de la réaction chimique
Il faut rincer les billes à l’eau pour enlever le calcium et empêcher ainsi la prolongation de la réaction. Le but est de former une pellicule gélifiée autour d’un cœur liquide. Il restera toujours du calcium donc si on attend longtemps la réaction aura toujours lieu et le cœur de la bille se solidifiera.
Protocol de l'expérience
Nous avons réalisé l’expérience deux fois afin d’obtenir un résultat. La première n’était pas réussie car nous n’avons pas respecté les ingrédients : on a utilisé du sirop de grenadine à la place du jus de framboise indiqué dans la recette du kit. Le sirop étant plus concentré en sucre, il nécessitait une dose d’alginate de sodium plus importante.
Recette :
Nous avons besoin de deux saladiers dont un transparent pour observer la formation des perles, d’une seringue, de cuillères doseuses, d’un fouet, d’une passoire, de sirop de grenadine, d’eau, et de deux ingredients essentiels : l’alginate de sodium et le sel de calcium.
On prépare une solution contenant 20Cl d’eau du robinet à laquelle on ajoute 1g d’alginate de sodium. On mixe la solution afin que l’alginate soit totalement dissout, puis on verse 10Cl de sirop de grenadine. On laisse reposer.
On prépare une seconde solution dans un saladier transparent contenant un demi-litre d’eau et 2,5 g de sel de calcium dissout.
On vérifie après avoir laissé reposer la solution d’alginate, si celui-ci est toujours bien dissout, si on ne voit pas apparaître quelques grumeaux.
On prélève quelques millitres de sirop de grenadine avec l’alginate de sodium à l’aide d’une grosse seringue, puis on verse goutte à goutte dans le bain de calcium : les caviars se forment.
On verse rapidement la solution dans une passoire pour conserver seulement les billes, que l’on rince sous l’eau froide quelques minutes.
On transvase les billes ainsi formées dans un petit récipient ou dans une boisson pour la colorer, et donner une texture originale lorsque l’on boit un cocktail par exemple…
Notre expérience en image
Préparation de la solution colorée

Alginate de sodium + eau

Mixage -> alginate dissout

Ajout de grenadine
Préparation du bain de calcium

Mixage sel de calcium + eau

Sel de calcium dissout
Préparation des perles

On prélève du liquide de la solution 1 à l’aide ld’une seringue, puis on verse goutte à goutte dans la solution 2 (bain de calcium) + Formation des perles.

On passe la solution de calcium contenant les perles à travers une passoire. On rince les billes sous l’eau.

Formation des perles