Emulsion
L'émulsion, qu’est-ce que c’est ?
L’émulsion est un mélange de deux substances liquides non miscibles (comme l’eau et l’huile par exemple). Le mélange reste stable grâce à un troisième ingrédient appelé émulsifiant.
Comment en réaliser une ?
Pour réaliser une émulsion il faut alors disperser des gouttelettes de matières grasses dans l’eau. Par exemple une mayonnaise est une émulsion connue de tous, la matière grasse est apportée par l’huile, la phase aqueuse par le jaune d’œuf qui est composé pour moitié d’eau ainsi que la moutarde, l’émulsifiant (substances qui, ajoutées à une denrée alimentaire, permettent de réaliser ou de maintenir le mélange homogène de deux ou plusieurs phases) est apporté par la lécithine (substance composée de phosphore, de lipides et de choline. Elle agit comme un émulsifiant naturel des substances graisseuses) du jaune d’œuf.
Quelles sont les différents types d’émulsion ?
On remarque 2 sortes bien particulières d’émulsion :
- Les émulsions stables c’est-à-dire les deux substances liquides restent bien liées grace à un émulsifiant, durant l’émulsion et quelque temps après, comme la mayonnaise et l’aïoli qui garde une texture onctueuse.
- Les émulsions instables, on appelle ça le phénomène de déstabilisation d’une émulsion, classé en deux phénomènes majeurs :
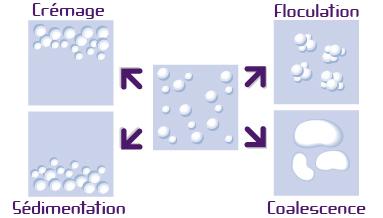
1) Les phénomènes migratoires : La différence de densité entre la phase aqueuse et la phase huileuse entraine une séparation de phase, on appelle cela le crémage (phase dispersée moins dense que la phase continue poussant celle-ci à migrer vers le haut). Par exemple pour la vinaigrette où l’huile et le vinaigre ont tendance à se séparer.
2) Les phénomènes d’augmentation de la taille : La taille des gouttelettes augmente de manière réversibles : la floculation (formation de flocons à partir des particules en suspension) ; ou irréversible : la coalescence (phénomène par lequel deux substances identiques, mais dispersées, ont tendance à se réunir).
Pourquoi sans emulsifiant l’eau et l’huile ne forme pas d’emulsion stable ?
Pour comprendre ce phénomène il faut aller voir les molécules des deux composants de plus près.
Tout d’abord l’eau : de formule H2O elle est composée d’un atome d’oxygène pour 2 atomes d’hydrogènes. Les molécules d'eau se lient entre elles grâce aux liaisons hydrogènes, entre un atome d'oxygène d'une molécule d'eau et un atome d'hydrogène d'une molécule d'eau voisine. La molécule d'eau est dite polaire car elle possède un pôle chargé négativement et l'autre positivement.

La molécule d’huile est formée d’atomes de carbones et d’hydrogènes, elle est appelée molécule triglycéride car elle arbore une forme de «râteau» à trois dents. Elle est apolaire (superposition des barycentres des charges négatives et du barycentre des charges négatives).

- L'eau est donc une molécule polaire, elle a un pôle chargé positivement et l'autre négativement. La molécule d'huile est dites apolaire. Elle n’a pas de zones positives et négatives. Elle ne peut donc pas se stabiliser avec les molécules d'eau car elle ne peut pas créer de liaisons hydrogène avec celle-ci.
- Et c’est à ce moment là qu’intervient l’émulsifiant : il possède des molécules tensioactives, qui sont amphiphiles (espèce chimique qui possède à la fois un groupe hydrophile miscible dans l’eau et un groupe hydrophobe retenant les matières grasses).
Elles présentent deux caractéristiques différentes : une retient les matières grasses elle est lipophile et apolaire, l'autre est miscible dans l’eau elle est hydrophile et polaire. Ces molécules vont enrober des gouttelettes d'huile appelées micelles, en mettant à leur contact leur partie lipophile, et disperser ces gouttelettes enrobées dans l'eau, en se liant aux molécules d'eau par leur partie hydrophile. Ainsi l’émulsion entre l’eau et l’huile aura lieu.Exemple d’émulsifiant : le jaune d’eau qui contient de la lecithine.

Micelle: Ensemble de molécules possédant une tête polaire hydrophile dirigée vers le solvant et une chaîne hydrophobe dirigée vers l'intérieur.
Petite expérience pour expliquer ça simplement :
Nous avons fait le test avec de l'huile et du vinaigre (première photo) nous avons alors remarqué que l'eau et l'huile preséntaient deux phases distinctes nous avons alors rajouté un oeuf (deuxième photo) les deux phases se mélangeaient (troisième photo). Nous avions alors affaire à une émulsion qui avait pour emulsifiant la lécithine du jaune d'oeuf.



L’émulsion revisité par la cuisine moléculaire.
Hervé This commenca par essayer de realiser une crème fouetté avec seulement de la crème : on appelle alors ce procédé chimique une émulsion. Apres un résultat plus que concluant, en effet il obtenu une chantilly parfaitement aérée , il décida alors de remplacer le corps gras : la crème, par un autre le cacao. Pour réaliser une mousse au chocolat il suffira alors de réaliser une emulsion contenant des goutelletes de beurre de cacao dans une substance : le gaz.
Différences entre émulsion et mousse !
Une mousse est très similaire à une émulsion : la seconde substance est alors un gaz (au lieu d'un liquide) dispersé sous forme de bulles .
Au niveau chimique
Une émulsion est un cas particulier de colloïde (Suspension stable de particules suffisamment petites pour que le mélange solide, liquide ou gazeux soit homogène.) Les deux substances liquides en présence sont appelées des phases. Une phase est continue. L'autre phase, discontinue, est dispersée dans la première phase sous forme de petites gouttelettes. Les émulsions sont souvent composées d'une phase aqueuse, semblable à de l'eau, et d'une phase huileuse, semblable à de l'huile.
Notre expérience :
Nous avons alors tenter de réaliser cette fameuse mousse au chocolat sans œuf et donc sans emulsifiant, comment cette mousse peut elle donc avec avoir une consistance correcte et être ainsi une émulsion stable ?
Pour la réalisation de cette recette/ expérience il nous faudra seulement :
- une tablette de chocolat noir
- de l’eau (90g d’eau pour 100g de chocolat)
- un peu de jus d'agrumes (facultatif, mais qui donne un certain goût !)
Tout d’abord nous avons fait fondre le chocolat coupé en morceaux dans une casserole, une fois totalement fondu nous l’avons laissé refroidir quelques minutes puis nous l’avons déposé dans un bain marie d’eau glacée. Par la suite il nous a suffit de fouetter énergiquement le chocolat fondu en prenant bien soin d’incorporer de l’air dans la préparation. Au bout d’environs 5/10 minutes le chocolat fondu avait pris la vrai texture d’une mousse bien aérée et légère. Nous avons fouetté jusqu’à que la mousse blanchisse légèrement passant de marron foncé à clair.
Nous n’avons eu besoin pour cette recette d’aucun additif particulier, elle est donc aisément réalisable pour chacun.
Que permet l’incorporation d’air dans le chocolat fondu ?
Comme il a été dit précédemment la base d’une mousse est une phase huileuse : le chocolat est alors mélangé à une autre phase, dans le cas d’une mousse : le gaz.
Ainsi l’incorporation «délicate» de gaz (l'air) dans la préparation permet de lui donner l’aspect de mousse.
Que permet le bain dans l’eau glacée ?
Le bain d’eau glacée permet ainsi la cristallisation (phénomène par lequel les parties d’une substance qui était à l’état gazeux ou dissoute dans un liquide se rapprochent les unes des autres, en vertu de leurs propres attractions, pour former un corps solide d’une figure régulière et déterminée) la matière grasse autour des bulles d’air, ce qui permet à la mousse de rester « mousseuse».
C’est donc pour cela que le fouettage et le refroidissement doivent être stabilisé.
Pour quelle raison doit on attendre que la mousse blanchisse légèrement ?
Ce changement de couleur est le signe de la présence de bulles d’air introduites par le fouet. Le blanchissement résulte de la présence de petites structures. Ainsi lorsque la mousse blanchit cela signifie que les gouttelettes de matières grasses sont assez fine, ce qui permet de savoir que la mousse est correctement aérée.




Les avantages de cette recette
Ce qui parait primordial c’est le côté facile de la recette qui révolutionne la vieille mousse au chocolat. En effet elle ne comporte pas d’œufs et est donc plus digeste, légère, économique et bien sûr beaucoup moins calorique.
Dans le cas de cette mousse au chocolat, la connaissance des réactions chimiques en cuisine (la cuisine moléculaire) aura permit la confection d’un dessert avec le strict minimum, c’est-à-dire ce qui lui donne du goût : le chocolat.
